Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты.
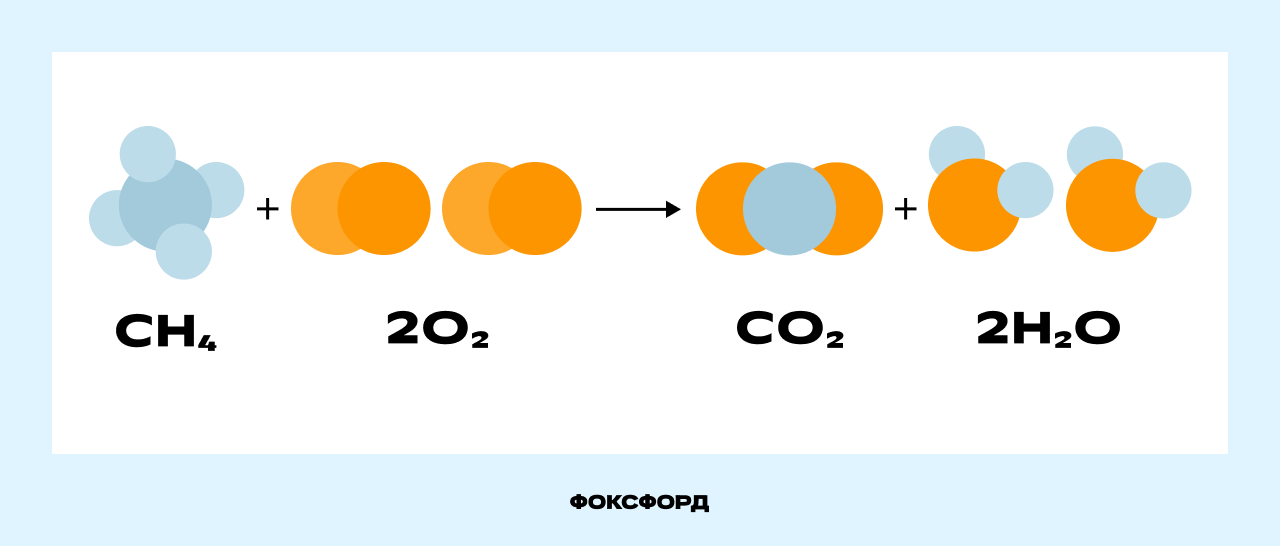
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций. Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта.
Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
2H2 + O2 = 2H2O
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
CaO + H2O = Ca(OH)2
Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
CaCO3 = CaO + CO2↑
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
Zn + 2HCl = H2↑ + ZnCl2
Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Типы химических реакций: таблица
| Тип реакции | Суть | Пример |
| Соединение | Два или несколько реагентов образуют один продукт | A+B=AB |
| Разложение | Одно вещество распадается на несколько более простых | AB=A+B |
| Замещение | Атомы в простом веществе замещают атомы в составе сложного вещества | A+BC=AC+B |
| Обмен | Два сложных вещества обмениваются составными частями | AB+CD=CB+AD |
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
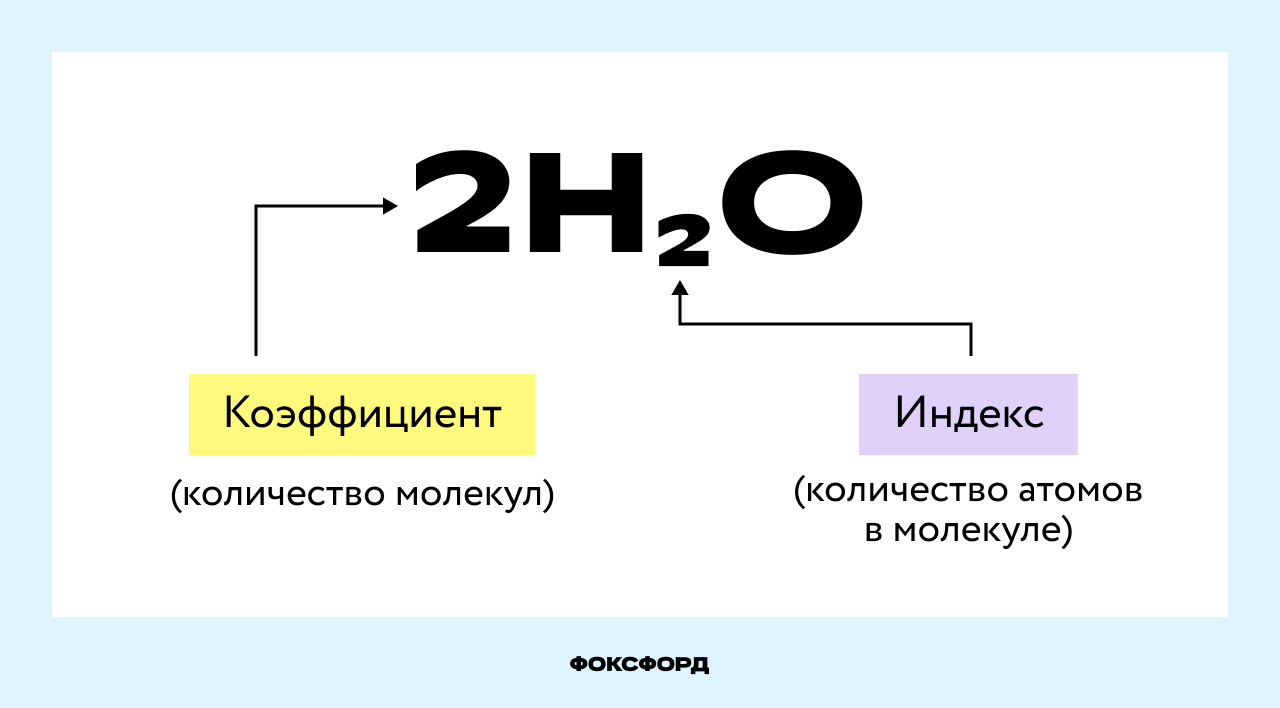
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Mg + O2 → MgO
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Mg + O2 → 2MgO
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
2Mg + O2 = 2MgO
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
KNO₃ → KNO₂ + О₂
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
2KNO₃ → KNO₂ + О₂
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия:
2KNO₃ = 2KNO₂ + О₂
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Ответим на ваши вопросы
Свяжемся с вами в течение 5 минут и проведём бесплатную консультацию по вопросам перехода на домашнее обучение
Позвоним с 8 до 21 в рабочие дни






